Мы — вид, который хакнул теорию Дарвина. Homo sapiens не желает больше полагаться на случайную эволюцию. Учёные редактируют ДНК, чтобы предотвращать болезни, менять растения и животных, уничтожать целые виды и давать жизнь новым. Властвуя над ДНК, мы заглядываем в прошлое, раскрываем преступления, копаемся в эволюции. Рассказываем, на что способна генетика, великая и ужасная.

ДНК КАК УЛИКА
Кому это надо
Сыщикам, прокурорам, адвокатам, судьям, а в итоге — всем добропорядочным гражданам.
В чём суть
Если вы оброните на улице жевательную резинку — мало ли, промахнулись мимо урны, — имейте в виду, что учёным достаточно нанограмма слюны, чтобы извлечь ДНК и реконструировать по ней вашу внешность. В 2019 году в такой ситуации оказались жители Гонконга, имевшие неосторожность намусорить. Компания Ogilvy собирала брошенные на тротуар жвачки и сигареты и выделяла ДНК из оставшейся на них слюны. По ДНК определяли цвет глаз, волос и кожи, форму лица, составляли жутковатый фоторобот провинившегося и вывешивали его на всеобщее осуждение.

Загрязнение улиц — самое безобидное из раскрытых таким образом преступлений. Правая рука полиции — ДНК-дактилоскопия, определение уникального генетического профиля человека. ДНК-профиль подозреваемых сравнивают с ДНК, обнаруженной в образцах на месте преступления (на волосах, в слюне, частицах кожи, крови, костях) или с имеющимися в базе данных. Впервые злодея вычислили по ДНК ещё в 1988 году.
Как это работает? ДНК всех людей совпадает на 99,9%. Но есть уникальные участки — повторяющиеся элементы, как будто ДНК-пластинку заело, и она несколько раз повторила один и тот же набор нуклеотидов. Количество таких повторов у каждого своё, но в любом геноме таких участков десятки. Этот уникальный узор можно считать ДНК-отпечатком.
Сейчас у криминалистов появилось новое орудие — генетическая генеалогия. В публичные базы данных вроде GENmatch люди загружают информацию о своей ДНК, чтобы отыскать родственников и построить генеалогическое древо. Но то же самое можно сделать с ДНК, взятой на месте преступления. В 2018 году так был пойман «убийца из Золотого штата», который десятилетие держал в страхе Калифорнию. Когда на GENmatch загрузили ДНК-профиль убийцы, удалось выявить 10−20 человек, у которых с ним были общие прапрапрапрабабушки и прапрапрапрадедушки. Генетическое семейное древо сузило список подозреваемых и позволило выйти на Джозефа Деанджело, вошедшего в историю как первый человек, пойманный в капкан генетической генеалогии.
Прогноз
ДНК-тестирование станет самым болтливым свидетелем в криминалистике будущего. Уже сейчас есть организации, которые предлагают гражданам сдать образец слюны, чтобы внести посильный вклад в борьбу с правонарушениями, или ищут спонсоров для проведения генетического расследования нераскрытых преступлений. В могуществе метода состоит и главная создаваемая им проблема: в прозрачном обществе будущего наша генетическая информация становится слишком доступной для тех, с кем ею вовсе не хочется делиться.
ДНК КАК МАШИНА ВРЕМЕНИ
Кому это надо
Историкам, археологам, палеоантропологам, а в итоге — всем, кто интересуется прошлым.
В чём суть
Генетика предложила новый способ заглянуть в прошлое — изучить древнюю ДНК. В 2010 году по пряди волос гренландца, жившего 4000 лет назад, была впервые в истории расшифрована полная геномная последовательность древнего человека. С тех пор палеогенетика набирала обороты и постоянно расширяла наши знания о миграциях и встречах далёких предков.
Расшифровав ДНК из маленькой косточки в мизинце, найденном в Денисовой пещере на Алтае, учёные обнаружили новую разновидность людей — денисовцев. От них не осталось практически ничего: три зуба, фаланга пальца да пара осколков черепа. Но благодаря анализу ДНК мы знаем, как они выглядели: денисовцы были смуглыми, кареглазыми и темноволосыми. А ещё — что соседями денисовцев по пещере были неандертальцы и что они оставили совместное потомство: девочка Денни, кончик мизинца который послужил отправной точкой для фундаментального открытия, была ребёнком неандертальской женщины и денисовского мужчины.

Денисовцы, как и неандертальцы, скрещивались и с нашими предками. На память об этом многим современным людям осталось по несколько процентов их ДНК. Опираясь на распределение ДНК-наследия, учёные предполагают, что денисовцы населяли Восточную Азию, затем по существовавшим 50−100 тысяч лет назад сухопутным перемычкам добрались до Папуа — Новой Гвинеи и Австралии. Вполне себе летопись, учитывая, что в руках исследователей было всего несколько костей и зубов.
Историкам интересно анализировать не только ДНК человека. Геном древней чумной палочки показал, что средневековую чуму принесли в Европу торговцы пушниной из Руси и Золотой Орды. Археогенетика сняла с европейцев обвинение в завозе туберкулёза в Новый Свет: это «вина» морских млекопитающих.
Прогноз
Во все времена люди обильно усеивали генами пол своих жилищ, ведь ДНК содержится в клетках кожи, фекалиях, следах мочи и крови. Поэтому будущее археогенетики закопано в землю: кости не нужны, когда ДНК выделяют из древних отложений почвы. Так, совсем недавно, исследуя ДНК в почве Денисовой пещеры, учёные обнаружили, что денисовцы, неандертальцы и наши предки сапиенсы жили там в один и тот же период — примерно 45 тысяч лет назад. Неужели встречались у костра?
ДНК КАК МЕДИЦИНСКИЙ ИНСТРУМЕНТ
Кому это надо
Врачам, фармацевтам, а в итоге — всем, кто хочет быть здоровым.
В чём суть
Возможности медицинской генетики хорошо описываются формулой «лечить нельзя предотвратить» — запятую поставьте сами. Если лечить нельзя, то нужно предотвратить. В Израиле, например, одно время рождалось довольно много детей (1 из 3000) с тяжёлым заболеванием Тея — Сакса: в возрасте около полугода ребёнок останавливается в развитии, теряет зрение, слух, способность глотать и в возрасте четырёх лет умирает. Теперь, когда в стране ввели обязательное тестирование на наличие мутации, приводящей к этой болезни, рождается один больной ребёнок на сотни тысяч.
Второй вариант — «лечить, нельзя предотвратить». Лечить, конечно, можно таблетками, а можно путём генетического вмешательства — активируя, подавляя и редактируя гены. Расскажу грустную историю. Жил-был мальчик по имени Дэвид, из-за мутации в ДНК его иммунная система не работала и любой чих был смертельно опасен. Мальчик прожил свою, увы, короткую жизнь в стерильном пузыре. Сейчас истории детей с синдромом «мальчика в пузыре» не такие грустные, потому что с 1990 года им на помощь пришла генетика. У пациента берут костный мозг, с помощью безвредного вируса встраивают в ДНК клеток нормальный ген, а затем отредактированные клетки подсаживают обратно больному. В результате иммунная система начинает работать.
Самая перспективная методика лечения рака — технология CAR-T — тоже основана на ДНК-редактировании. К клеткам иммунной системы (т-лимфоцитам) добавляют ген рецептора, распознающего раковые клетки, и затем эти наведённые на цель лимфоциты отправляют в организм кромсать опухоль.
Ещё одно интересное направление генетического вмешательства — технология «вторая мама». В 2016 году мир облетела новость: родился ребёнок от трёх родителей. У женщины в супружеской паре была «поломка» в митохондриальной ДНК, из-за чего первые два ребёнка скончались от синдрома Лея. Митохондрии и их ДНК передаются толькоот мамы, поэтому смертельное заболевание было практически гарантировано всем будущим детям пары. Доктор Джон Чжан предложил взять здоровые митохондрии от женщины-донора и подсадить их в яйцеклетку матери. Так на свет появился здоровый малыш от трёх родителей. Сейчас таких детей в мире уже трое.
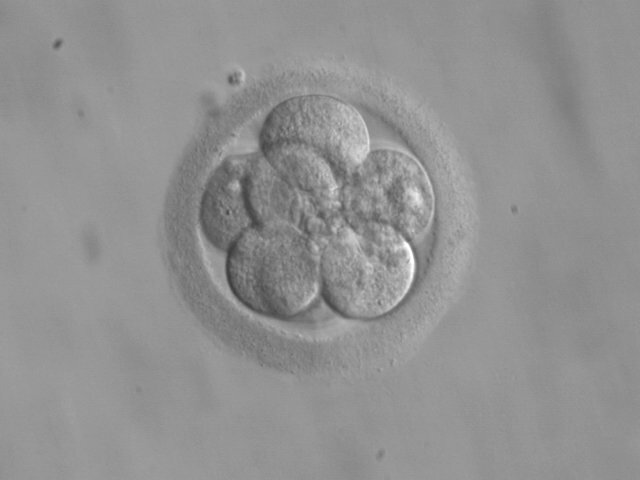
Прогноз
Расшифровка первого человеческого генома заняла 13 лет, сегодня это можно сделать за двое суток. Мы уже знаем мутации, которые приводят к раку, болезням Альцгеймера, Паркинсона и ещё примерно 7000 заболеваний. Следующим шагом станет внедрение персонализированного подхода. В медицинских кабинетах появятся мини-секвенаторы размером чуть больше USB-флешки. Вы внесёте в секвенатор образец слюны, он пожужжит, проанализирует геном, и врач подберёт лечение с учётом вашей ДНК.
Уже возникла целая наука, изучающая, как вариации в генах определяют различия во всасывании, переработке и действии лекарств, — фармакогеномика. На гены приходится до 50% различий в побочных реакциях. Существуют фармакогеномные базы данных, заглянув в которые можно подобрать лечение, подходящее для генов конкретного пациента. Заодно можно проверить и геном бактерий кишечника — невидимый орган, который влияет на энергообмен, иммунитет, помогает переваривать пищу и производит витамины.
Анализ микробиоты позволит подобрать диету — выяснить, надо вам есть побольше паслёновых или бобовых. Домашние тесты на микробиом уже существуют. Мини-секвенаторы, например кроха MINION, — тоже. Генетика изменит медицину так, что стандартный подход будет казаться нам таким же древним и странным, как кровопускание или лечение ядами.
ДНК КАК ЗАПОМИНАЮЩЕЕ УСТРОЙСТВО
Кому это надо
Создателям устройств хранения информации, а в итоге — всем, кто считает, пишет, снимает.
В чём суть
Примерный расчёт показывает: для хранения всей накопленной человечеством информации нужен лишь один килограмм одной ДНК. Объём цифровых данных неуклонно растёт. К 2040 году нас ждёт кризис в области систем хранения: закончится кремний, необходимый для производства HD-дисков и прочих архивов.
Что делать? Генетики отвечают: обратиться к ДНК с её огромной плотностью упаковки информации — весь человеческий геном помещается в крохотной клетке, точнее в её ядре. К тому же ДНК долговечнее флешек: после трёх лет использования HD-диска доверять ему данные уже не стоит. Как долго продержится ДНК? До 700 000 лет — спустя столько времени из кости, найденной в вечной мерзлоте, удалось извлечь ДНК лошади.
Учёные давно экспериментируют с ДНК-памятью. В 1988 году Джо Дэвис закодировал в ДНК древнегерманскую руну жизни объёмом в 32 бита. В 2013-м в ДНК записали 5 файлов на 739 килобайт — сонеты Шекспира и речь Мартина Лютера Кинга. Через пару лет рекорд побили учёные из Microsoft и Вашингтонского университета — 200 мегабайт: музыкальный клип и фильм 1902 года «Путешествие на Луну».
Прогноз
Чтобы ДНК стала жизнеспособной технологией хранения, нужно научиться надёжно кодировать и извлекать информацию, ведь при синтезе и расшифровке ДНК один из ста нуклеотидов оказывается ошибочным. Придётся нарастить объёмы хранения и ускорить процесс: на кодирование информации нуклеотидами уходят часы, а извлечение — дело ещё более долгое. Впрочем, новые технологии «прочтения» ДНК появляются каждые пару лет.
ДНК КАК КНИГА ЖИЗНИ
Кому это надо
Зоологам, а в итоге — всем, кто хочет понимать многообразие жизни.
В чём суть
В 2017 году стартовал проект «Геном позвоночных» — создание базы данных геномов всех 66 000 видов позвоночных. Зачем тратить на это время и деньги? Сравнивая ДНК, можно определить, какие элементы за какие черты отвечают. Например, у людей и шимпанзе геномы похожи на 99%, значит, оставшийся 1% и отвечает за отличия человека от обезьяны.
Если мы сравним геномы людей и других млекопитающих с геномами птиц, то найдём общие гены млекопитающих, отличающиеся от генов птиц. Так сравнительная генетика позволяет лучше понять эволюцию. Можно сравнивать геномы внутри одного вида — например, у стремительно меняющихся вирусов.
Сейчас генетики с замиранием сердца следят за коронавирусом: у штамма альфа мутация произошла в белке, отвечающем за подавление иммунитета человека, у дельта-варианта мутировал ген поверхностного белка, поэтому вирус перестал распознаваться иммунной системой организма. Зная, какие гены в ДНК или РНК вируса за что отвечают, мы можем предположить, от каких мутаций ждать беды. Сравнивая гены и их расположение, генетики делают выводы об их функции. Если ген похож на какой-то уже изученный, скорее всего, они делают примерно одно и то же.
Прогноз
Революционное удешевление секвенирования в последние годы превратило биологию в науку, богатую данными. Теперь на первый план выступают проблемы их хранения и обработки. Занимается этим биоинформатика — дисциплина, которая становится всё важнее и популярнее. А значит, будет появляться всё больше «сухих» лабораторий, в которых царствуют не реактивы, а компьютеры.
ДНК КАК АГРОНОМ
Кому это надо
Работникам сельского хозяйства, а в итоге — всем, кто любит вкусно и недорого поесть.
В чём суть
Гордую надпись «не содержит ГМО» без разбора лепят на все продукты, от колбас до соли. Но если честно, гордиться тут особенно нечем. Ведь генно-модифицированные продукты способны повысить урожайность, решить проблему голода, уменьшить вред от сорняков и вредителей и поддержать экологию. Вводя те или иные гены в растения, учёные сделали их устойчивыми к холоду, насекомым-вредителям, затоплению; вывели сорта с повышенной урожайностью и с добавлением витаминов. У генно-модифицированных организмов длинный список достоинств. ГМО-картофель, кукуруза и рис содержат больше белка, льняное семя — полезных жиров. В ГМО-помидорах больше антиоксидантов. А ГМО-салат содержит железо в легкоусвояемой форме.

Прогноз
Учёные и ВОЗ в целом согласны, что генно-модифицированные культуры безопасны, но неспециалисты побаиваются ГМО и запрещают их выращивать. При этом население планеты растёт — и едва ли мы сможем прокормить всех, если сельское хозяйство не начнёт шагать в ногу с биотехнологиями. Неудивительно, что агрогенетика получает всё большее распространение.
ДНК КАК РУКА БОГА
Кому это надо
Санитарным врачам, аграрникам, а в итоге — всем, кто не любит вредных и опасных животных.
В чём суть
Вы ведь знаете о самом смертоносном для людей животном планеты? Это комар Anopheles, эксклюзивный распространитель малярийного плазмодия. От малярии ежегодно умирают более 400 000 человек. Справиться с этой болезнью поможет генный драйв — технология, позволяющая изменить ген так, чтобы 100% потомков его унаследовали. Берём комара, вносим в его ДНК молекулярные ножницы CRISPR/Cas9, нацеленные на ген, который отвечает за определение пола насекомого. Если этот ген повредить, организм самок так и не определится, мальчик он или девочка, и не оставит потомства.
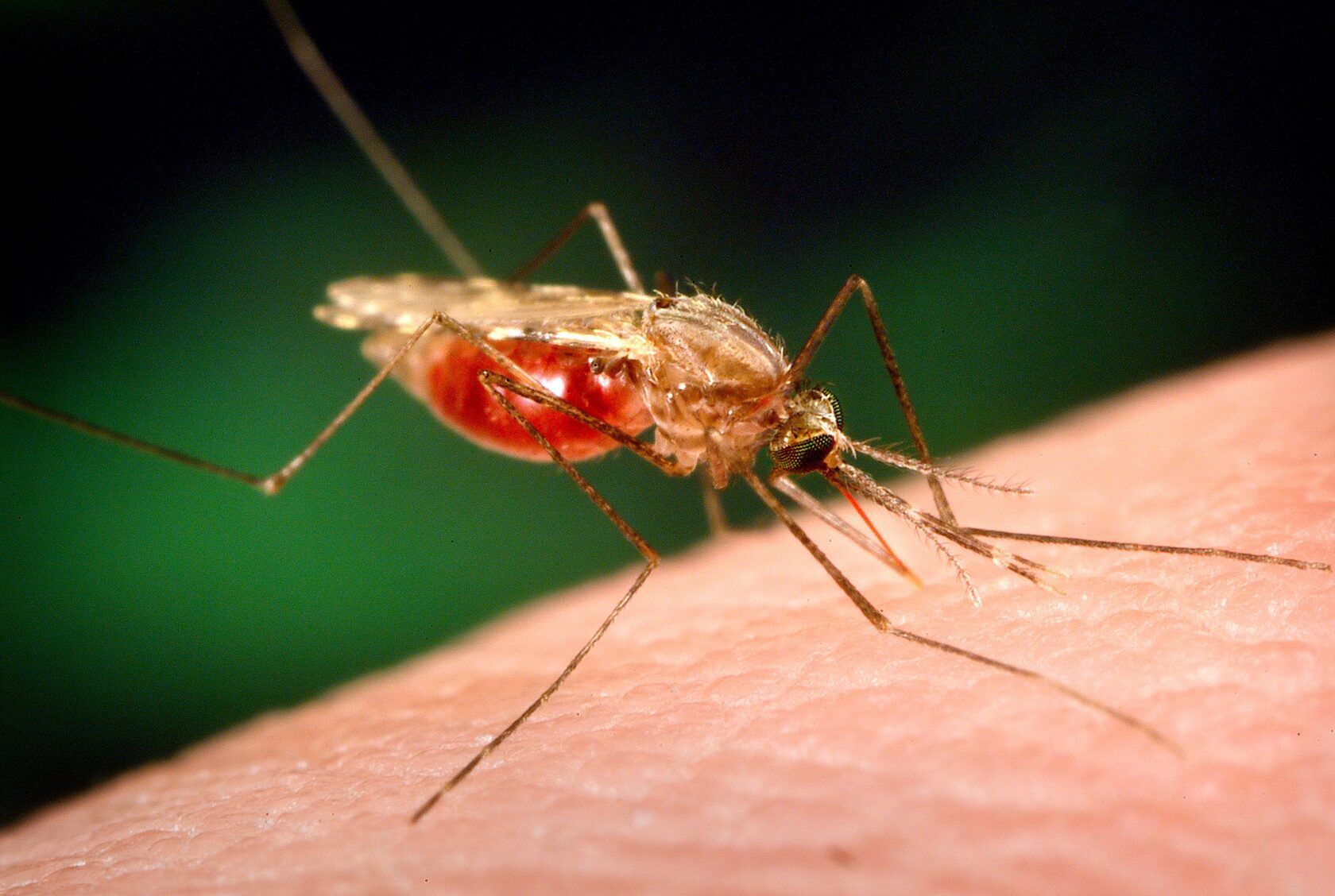
Теперь выпускаем ГМО-комарика в природу, где он находит комариху. У всех их остроносых детей молекулярные ДНК-ножницы от папы разрежут ген размножения. Все дочки окажутся стерильными, сыновья же распространят мутацию и оставят следующее поколение неплодовитых комаров. Через некоторое время популяция практически вымрет, а вместе с ней и малярия.
В июле 2021 года были опубликованы результаты полузакрытого полевого исследования — эксперимента в очень больших клетках, имитирующих природу. Генный драйв полностью подавил популяцию комаров за год, а устойчивость к нему так и не выработалась.
Цель генного драйва номер два — грызуны. Европейцы завезли в Австралию и Новую Зеландию крыс, мышей, кроликов и опоссумов. Эта лесная братва размножилась и проводит рейдерский захват территории, вытесняя сумчатых животных и отбирая их еду. С обнаглевшими грызунами пытались справиться с помощью вирусов, а сейчас планируют попробовать генный драйв. Биологи из Калифорнийского университета успешно испытали технологию на мышах.
Прогноз
Экоактивисты считают, что учёные заигрались в бога, решая, каким видам жить, а каким умереть, и призывают запретить технологию. Однако ко времени полномасштабного запуска мы будем гораздо лучше понимать, на что способен генный драйв. Если он не сработает, ГМО-комары просто исчезнут, если же всё пойдёт по плану — резко сократится популяция дикого типа. Со временем, устранив малярию, мы сможем выпустить в природу здоровых, без плазмодия, комаров, если уж они нам так нравятся. Можно, впрочем, стараться побороть малярию с помощью инсектицидов, антималярийных сеток и осушения болот. Но тогда для полного уничтожения болезни потребуется лет пятьдесят, а это 20 миллионов человеческих жизней. Готовы ли мы ждать?
Фото: Ktsdesign/Shutterstock; Ogilvy & Mather Hong Kong; Maayan Harel; ekem/RWJMS IVF Program; a katz, RIDVAN_BULBUL/Shutterstock; pixabay.com
Опубликовано в журнале «Кот Шрёдингера» № 46 2021 г.
